Comment déterminer les cibles ?
La TMS a débuté à Strasbourg en 2003 avec l'obtention d'un contrat de la Région Alsace et d'un PRI couvrant l'achat d'un premier stimulateur et d'un système de navigation. Nous étions les premiers en France à bénéficier de ce type de matériel. Au départ son développement s'est fait exclusivement dans le cadre de la recherche sur les épilepsies partielles corticales motrices et des hallucinations résistantes.
Autant la localisation d'une activité épileptique était déjà monnaie courante à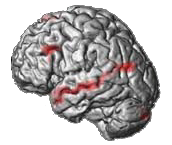 l'époque, autant c'était une complète nouveauté dans le cadre des hallucinations. Nous avons capitalisé sur le fait que les hallucinations étaient phasiques, c'est à dire qu'elles variaient au cours de l'acquisition d'une IRMf. Dans ce cas, une mesure relative de l'activité cérébrale est suffisante. C'est l'imagerie en effet BOLD classique assez facile à maitriser. Mais ses résultats étaient peu reproductibles chez un même patient si on utilisait les techniques standards. Aussi nous avons mis au point des méthodes spécifiques d'acquisition et d'analyse de données. Nous avons pu démontrer leur supériorité en terme de reproductibilité chez un même patient par rapport à la méthode de référence. Cette fois la reproductibilité était suffisante pour qu'elle puisse servir à guider une stimulation sur mesure (fig. 1, kappa voxel à voxel de ~0.6 vs 0.1 avec la méthode de référence). De plus, cela nous a permis de nous rendre compte de la très forte variabilité entre les différents patients justifiant d'autant une approche personnalisée.
l'époque, autant c'était une complète nouveauté dans le cadre des hallucinations. Nous avons capitalisé sur le fait que les hallucinations étaient phasiques, c'est à dire qu'elles variaient au cours de l'acquisition d'une IRMf. Dans ce cas, une mesure relative de l'activité cérébrale est suffisante. C'est l'imagerie en effet BOLD classique assez facile à maitriser. Mais ses résultats étaient peu reproductibles chez un même patient si on utilisait les techniques standards. Aussi nous avons mis au point des méthodes spécifiques d'acquisition et d'analyse de données. Nous avons pu démontrer leur supériorité en terme de reproductibilité chez un même patient par rapport à la méthode de référence. Cette fois la reproductibilité était suffisante pour qu'elle puisse servir à guider une stimulation sur mesure (fig. 1, kappa voxel à voxel de ~0.6 vs 0.1 avec la méthode de référence). De plus, cela nous a permis de nous rendre compte de la très forte variabilité entre les différents patients justifiant d'autant une approche personnalisée.
Extension du concept, recherche cibles personnalisées dans la dépression
Il devenait dès lors tentant d'appliquer la mêle démarche à d'autres pathologie. Nous nous sommes alors intéressé aux troubles de l'humeur. La rTMS y a déjà fait preuve de son efficacité, mais celle-ci n'est pas complète. Nous nous demandions s'il pouvait exister une marge de progression en personnalisant la stimulation.
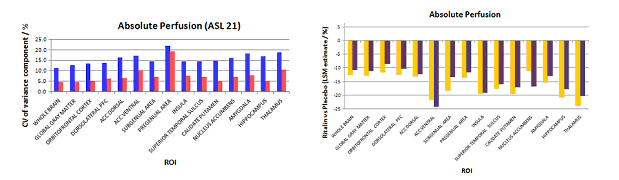
Mais comment mettre en évidence les cibles ? En effet dans le cas de la dépression, le symptôme est tonique, c'est à dire qu'il ne varie pas ou trop peu au cours de l'acquisition. Dans ce cas il faut comparer l'activité du patient à une référence et la mesure doit alors être absolue. Nous avons mis au point des techniques de mesure du rCBF (débit sanguin cérébrale) en IRM sans injection de produit de contraste par ASL (arterial spin labeling). L'examen est donc réalisable de façon répétée si nécessaire, sans risque pour le patient, et sa reproductibilité est plus de deux fois supérieure à celle publiée pour la technique de référence, la tomographie à émission de positron (PET) à l'H2O marquée (fig. 2). Elle est aussi deux fois supérieure à celle du PET au fluoro-desoxyglucose, même si le paramètre mesuré n'est pas superposable. Elle peut non seulement être utilisée à visée pré-thérapeutique, mais aussi pour suivre l'efficacité du traitement (fig. 2, histogramme de droite).
Un robot pour des stimulations complexes de haute précision
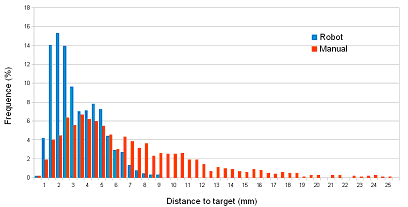
Une fois les cibles déterminées, il est rapidement apparu que ce type de protocole de stimulation personnalisé ne pouvait pas être réalisé par des opérateurs humains dans le cadre d'une routine clinique. En effet un opérateur humain ne peut au mieux assurer qu'une seule séance par jour en raison de la fatigue générée. Aussi, en collaboration avec l'équipe de robotique de Michel de Mathelin (LSIIT, futur laboratoire Icube), nous avons développé un robot destiné au pilotage de grande précision de la TMS. Les tests que nous avons effectués chez le sujet sain ont clairement montré non seulement la supériorité en terme de précision (fig. 3), mais aussi en terme de fatigue (24 ±23 vs. 82 ±11) et de confort (92 ±5 vs. 27 ±14) pour l'opérateur.
Avantages d'un traitement personnalisé
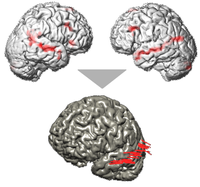 La robotisation permet la stimulation non plus d'un seul point, mais de toute une région, aussi complexe soit-elle. Sur la figure ci-contre, on voit les régions impliquées dans les hallucinations de façon reproductible chez le même sujet que celui de la figure 1 (fig. 4 partie haute). Lors d'une séance de validation, nous avons stimulé le sillon temporal supérieur gauche. C'est ce qu'illustre la partie basse de la figure 4 où chaque trajectoire représente la position de la bobine de stimulation toutes les 50 pulses. On voit que la stimulation a pu être appliquée de façon homogène tout le long du sillon.
La robotisation permet la stimulation non plus d'un seul point, mais de toute une région, aussi complexe soit-elle. Sur la figure ci-contre, on voit les régions impliquées dans les hallucinations de façon reproductible chez le même sujet que celui de la figure 1 (fig. 4 partie haute). Lors d'une séance de validation, nous avons stimulé le sillon temporal supérieur gauche. C'est ce qu'illustre la partie basse de la figure 4 où chaque trajectoire représente la position de la bobine de stimulation toutes les 50 pulses. On voit que la stimulation a pu être appliquée de façon homogène tout le long du sillon.
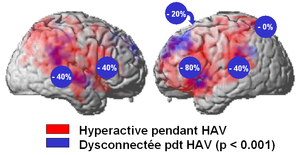 Dans le domaine des hallucinations, cette approche a permis d'optimiser le taux de répondeurs. Ci-bas jusqu'à 80% des patients présentaient une réduction de plus de 50% de leurs hallucinations lors de la stimulation de leur cortex frontal basal gauche (figure 5). Si nous avions utilisé les protocoles classiques appliqués à l'aveugle, en l'absence de bilan localisateur (stimulation du sillon temporal supérieur), le taux de réponse aurait été de 40%...
Dans le domaine des hallucinations, cette approche a permis d'optimiser le taux de répondeurs. Ci-bas jusqu'à 80% des patients présentaient une réduction de plus de 50% de leurs hallucinations lors de la stimulation de leur cortex frontal basal gauche (figure 5). Si nous avions utilisé les protocoles classiques appliqués à l'aveugle, en l'absence de bilan localisateur (stimulation du sillon temporal supérieur), le taux de réponse aurait été de 40%...
Au-delà d'une meilleur réponse thérapeutique, on s'attend à ce que cette approche réduise encore le risque d'effets indésirables cognitifs par rapport aux protocoles thérapeutiques "à l'aveugle". Mais cela reste à démontrer.
